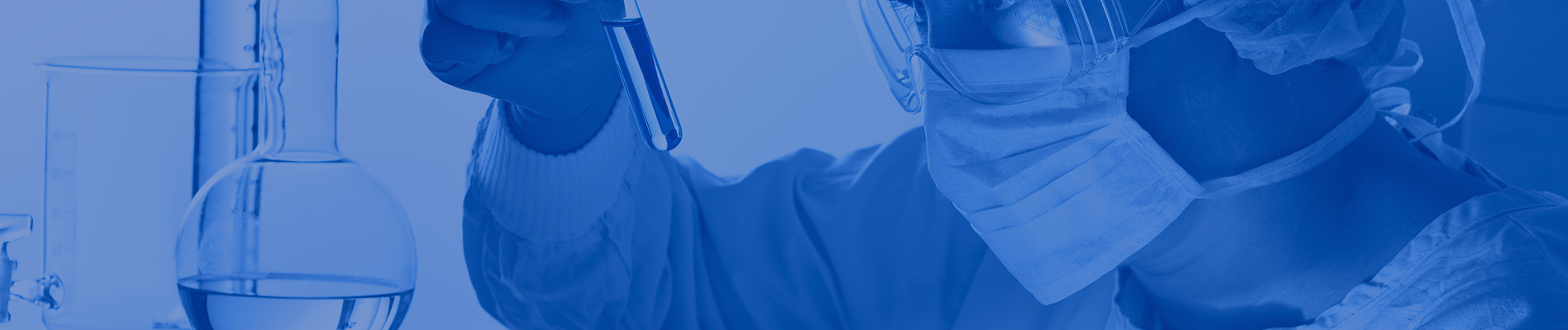
Sinopharm (Pequim): BBIBP-CorV
FASE 1
1 ensaio
ChiCTR2000032459
China
FASE 2
2 ensaios
NCT04962906
Argentina
ChiCTR2000032459
China
FASE 3
6 ensaios
NCT04984408
ChiCTR2000034780
Emirados Árabes Unidos
NCT04612972
Peru
NCT04510207
Bahrain, Egito, Jordânia, Emirados Árabes Unidos
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Emirados Árabes Unidos
Aprovações
Lista de uso de emergência da OMS 59 países
Angola 、 Argentina 、 Bahrein 、 Bangladesh 、 Bielo-Rússia 、 Belize 、 Bolívia (Estado Plurinacional da) 、 Brasil 、 Brunei Darussalam 、 Camboja 、 Camarões 、 Chade 、 China 、 Comores 、 Egito 、 Guiné Equatorial 、 Gabão 、 Gâmbia 、 Geórgia 、 Indonésia 、 Hungria 、 Indonésia 、 Irã (República Islâmica do) 、 Iraque 、 Jordânia 、 Quirguistão 、 República Democrática Popular do Laos
Líbano 、 Malásia 、 Maldivas 、 Mauritânia 、 aurício 、 Mongólia 、 Montenegro 、 Marrocos 、 Moçambique 、 Namíbia 、 Nepal 、 Níger 、 Macedônia do Norte 、 Paquistão 、 Paraguai 、 Peru 、 Filipinas 、 República do Congo 、 enegal 、 Sérvia 、 Seychelles 、 Serra Leoa 、 Salomão Ilhas 、 Somália 、 Sri Lanka 、 Tailândia 、 Trinidad e Tobago 、 Tunísia 、 Emirados Árabes Unidos 、 Venezuela (República Bolivariana da) 、 Vietnã 、 Zimbábue
Sinopharm BBIBP-CorV COVID-19 é uma vacina inativada feita a partir de partículas de vírus cultivadas em cultura que não possuem capacidade patogênica. Esta vacina candidata foi desenvolvida pela Sinopharm Holdings e pelo Instituto de Produtos Biológicos de Pequim.
A vacina Sinopharm BBIBP-CorV atua permitindo que o sistema imunológico produza anticorpos contra o beta coronavírus SARS-CoV-2. Vacinas de vírus inativados têm sido usadas há décadas, como a vacina contra a raiva e a vacina contra hepatite A. Esta tecnologia de desenvolvimento foi aplicada com sucesso a muitas vacinas conhecidas, como a vacina contra a raiva.
A cepa SARS-CoV-2 de Sinopharm (cepa WIV04 e número de biblioteca MN996528) foi isolada de um paciente no Hospital Jinyintan em Wuhan, China. O vírus foi propagado em cultura em uma linha de células Vero competente, e o sobrenadante das células infectadas foi inativado com β-propiolactona (1: 4000 vol / vol, 2 a 8 ° C) por 48 horas. Após a clarificação dos restos celulares e ultrafiltração, uma segunda inativação da β-propiolactona foi realizada nas mesmas condições da primeira inativação. De acordo com a OMS, a vacina foi adsorvida em 0,5 mg de alúmen e carregada em seringas pré-cheias em 0,5 mL de solução salina tamponada com fosfato estéril sem conservantes.
Em 31 de dezembro de 2020, a State Drug Administration anunciou a aprovação da vacina experimental desenvolvida pela Sinopharm.
Em 7 de maio de 2021, a Organização Mundial da Saúde anunciou a aprovação da vacina. A lista de uso de emergência da OMS permitiu que os países agilizassem suas próprias aprovações regulatórias para importar e administrar a vacina COVID-19. O Grupo Consultivo de Especialistas em Estratégias de Imunização também concluiu sua revisão da vacina. Com base em todas as evidências disponíveis, a OMS recomenda duas doses da vacina, com três a quatro semanas de intervalo, para adultos com 18 anos ou mais. A eficácia da vacina contra doenças sintomáticas e hospitalizadas é estimada em 79% para todas as faixas etárias combinadas.
A American Medical Association publicou "A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Syntomatic COVID-19 Infection in Adults" in 26 de maio de 2021, concluindo que "nesta análise provisória pré-especificada de um ensaio clínico randomizado, adultos As 2 vacinas inativadas de SARS-CoV-2 administradas nesta análise intermediária pré-especificada de ensaios clínicos randomizados reduziram significativamente o risco de COVID-19 sintomático, e eventos adversos graves foram raros. " Neste ensaio randomizado de fase 3 em adultos, a eficácia das 2 vacinas de vírus inteiros inativados em casos sintomáticos de COVID-19 foi de 72,8% e 78,1%, respectivamente. 2 vacinas tiveram eventos adversos graves raros com frequência semelhante ao grupo de controle apenas de alúmen, e a maioria não estava relacionada à vacinação. Uma análise exploratória descobriu que as 2 vacinas induziram anticorpos neutralizantes mensuráveis, semelhantes aos resultados do ensaio de fase 1/2.
O Grupo de Trabalho SAGE da OMS publicou uma revisão da vacina Sinopharm / BBIBP COVID-19 em 10 de maio de 2021. A vacina COVID-19 da GAVI incorpora um monitor de frasco de vacina que informa aos profissionais de saúde se a vacina foi armazenada adequadamente e não foi exposta a superaquecimento. Como resultado, danos, GAVI relatou em 14 de maio de 2021. etiquetas inteligentes fabricadas pela Zebra Technologies e feitas pela Temptime Corporation, consistem em um círculo com um quadrado de cor mais clara no meio, feito de um produto químico incolor que desenvolve cor irreversivelmente ao longo do tempo . Isso se torna mais escuro para dar uma indicação visual da exposição cumulativa ao calor. Uma vez que o frasco tenha sido exposto ao calor além de sua faixa de armazenamento ideal, o quadrado se torna mais escuro que o círculo, indicando que a vacina não deve mais ser usada.
Número de registro da biblioteca de medicamentos para vacinas COVID-19 da National Drug BBIBP-CorV: DB15807.